Resumen
Por la necesidad de
utilización de estrategias didácticas que le permita al estudiante utilizar los
aprendizajes para enfrentar los problemas que enfrenta en la vida cotidiana, se
propuso el objetivo de diseñar un modelo para una unidad didáctica con una justificación
teórica de los elementos a introducir, su contextualización, los objetivos , los
contenidos, la metodología, actividades a desarrollar en el aula y se establecieron finalmente los criterios de evaluación,
sobre la base de los principios didácticos. El proyecto tendrá su
aplicación en los estudiantes de
primer año de la carrera de Licenciatura en Pedagogía de la Química de la Universidad
Técnica “Luis Vargas Torres”, Esmeraldas, Ecuador. Los resultados buscan contribuir
a la formación de los nuevos docentes centrada en lograr que nuestros
estudiantes aprendan con profundidad la ciencia que enseñan, que tengan un
dominio conceptual y metodológico, que dominen los
fundamentos didácticos y pedagógicos para la enseñanza de la asignatura,
apliquen la relación teoría –práctica en el ejercicio docente, estén motivados
por la investigación de los problemas del aula y sean creativos en la
conducción del proceso y en la aplicación del proceso evaluativo. Se concluye
que la enseñanza de la Química no puede reducirse a dictar conceptos y teorías,
a un proceso de memorización en abstracto. Se requiere de una mayor
dinamización de las clases, donde los estudiantes vean la aplicación práctica
de todos esos conceptos y teorías estudiadas en clases en su vida diaria.
Palabras clave: Programación didáctica; unidad didáctica; conceptos fundamentales de la
química; conocimiento
pedagógico del contenido; formación inicial de docentes.
Abstract
Due to the
need to use teaching strategies that allow the student to use learning to face
the problems they cope with in daily life, the objective was proposed to design
a model for a teaching unit with a theoretical justification of the elements to
be introduced, their contextualization, the objectives, the contents, the
methodology, activities to be developed in the classroom and finally the
evaluation criteria were established, based on the didactic principles. The
project will be applied to first-year students of the bachelor’s degree in Pedagogy
of Chemistry, at the “Luis Vargas Torres” Technical University, in Esmeraldas,
Ecuador. The results seek to contribute to the training of new teachers focused
on ensuring that our students learn in depth the science they teach, that they
have a conceptual and methodological mastery, that they master the didactic and
pedagogical foundations for teaching the subject, apply the relationship
theory-practice in the teaching exercise, are motivated by the investigation of
classroom problems and are creative in conducting the process and in the
application of the evaluation process. It is concluded that the teaching of
Chemistry cannot be reduced to dictating concepts and theories, to a process of
abstract memorization. A greater dynamization of classes is required, where
students see the practical application of all those concepts and theories
studied in classes in their daily lives.
Keywords: Didactic programming; didactic unit; fundamental concepts
of chemistry; pedagogical content knowledge; initial teacher training.
Formación
Profesional de los Estudiantes de la Carrera de Pedagogía de la Química: Modelo Conceptual-Metodológico
con Fundamentos Didácticos
En las nuevas concepciones sobre el aprendizaje, donde no solo se
aspira a una mayor autonomía del alumno, sino que es también donde el profesor
juega un papel de mediador entre el alumno y la tarea, porque es el alumno quien
construye sus aprendizajes y el profesor se constituye en el guía, se requiere
de un diseño didáctico eficaz para lograr un aprendizaje significativo de los
contenidos, competencias y habilidades de la carrera específica, desarrollando
la motivación, procurando la inclusión, la atención a la diversidad y la
enseñanza diferenciada. Todos estos factores determinantes han conllevado al
autor a diseñar un modelo conceptual-metodológico con fundamentos didácticos.
El modelo
se enmarca en el área de Profesionalizador de Diseño y el mismo está dirigido
al diseño de una unidad didáctica sobre los conceptos fundamentales de la
química, la cual se ha concebido para los estudiantes de primer año de la
carrera de Licenciatura en Pedagogía de la Química de la facultad de Ciencias
de la Educación, de la Universidad Técnica de Esmeraldas “Luis Vargas Torres”.
En esta universidad del Ecuador se ha llegado a establecer la
existencia de una diversidad de trabajos de investigación relacionados con
diferentes tópicos llevados a cabo por estudiantes como requisito de grado
académico, pero son tesis que enfocan aspectos de la educación en general, pero
no hay una que hable sobre la planificación por unidades didácticas en la
carrera de Química; de ahí la necesidad de hacer un estudio que responda a las
necesidades del contexto y, específicamente, a la formación del profesorado
según las exigencias de modelos que promuevan la actividad independiente y
creativa de los alumnos a lo largo de su proceso formativo.
El modelo de programación que presentamos concibe la
redacción de los objetivos de aprendizaje en relación con los contenidos de la
asignatura y los criterios de evaluación, y los mismos se conducen a la
consecución de los tres tipos de saberes que definen las acciones de las
competencias: el saber, el saber hacer y el saber estar.
La resolución de problemas en la enseñanza de la Química,
como se propone en el planteamiento de esta unidad didáctica, está dirigida a
lograr que los estudiantes vean los conocimientos que adquieren en la signatura
como las herramientas que le van a permitir comprender y resolver las
situaciones problémicas que se le presentan en su entorno. De esta forma, se
pretende contribuir a la formación de los nuevos docentes centrada en lograr
que nuestros estudiantes aprendan con profundidad la ciencia que enseñan, que
tengan un dominio conceptual y metodológico, que dominen los fundamentos
didácticos y pedagógicos para la enseñanza de la asignatura, apliquen la
relación teoría–práctica en el ejercicio docente, estén motivados por la
investigación de los problemas del aula, sean creativos en la conducción del
proceso y en la aplicación del proceso evaluativo.
Desde el punto de vista académico, el presente trabajo ofrece un modelo
en el cual se dan las pautas sobre el uso de los recursos didácticos,
los cuales para Feo (2015):
Son las vías motivadoras, activas y transformadoras que nos
permitirán alcanzar las metas de aprendizaje propuestas, ya que actualmente los
docentes no pueden reducir su accionar a las explicaciones orales, por lo que
requiere el conocimiento, utilización y aplicación de los diferentes recursos
didácticos en las diferentes situaciones de aprendizaje (p.16).
Mientras Suárez (2000) las visualiza
como las
herramientas para identificar, trabajar y evaluar a los alumnos según sus
estilos de aprendizaje, que se definen como las variables personales
que, a mitad de camino entre la inteligencia y la personalidad, explican las
diferentes formas de abordar, planificar y responder ante las demandas del
aprendizaje; y Gallego (2006) las plantea como las diferentes formas e instrumentos de evaluación del
aprendizaje y donde las implicaciones de la formación competencial en la
evaluación implican considerar diferentes métodos de evaluación, que
constituyan evidencias validas de logro de los estudiantes.
Con esta unidad didáctica proponemos una metodología para la enseñanza
de los conceptos básicos de la química que propicie el trabajo en equipo y el
desarrollo de competencias, a la vez que fomenta ambientes de aprendizaje que
involucran a los estudiantes en la búsqueda y construcción de estrategias de
aprendizaje que los conduzcan al desarrollo de competencias académicas y
científicas. Para lograrlo, la fundamentación teórica se centró en los
postulados de:
- los conceptos fundamentales de la química, en los que se identifican cuatro grandes temas presentes en todos los
currículos y que están integrados por conceptos fundamentales: mezcla,
compuesto y elemento, átomo, protón, neutrón y electrón, fórmulas y lenguaje
químicos (García, 2008).
- el conocimiento pedagógico del contenido, como “el conocimiento que va más allá del tema per se y que
llega a la dimensión del conocimiento del tema de la materia para la enseñanza”
(Shulman et al., 1999, p.9). Desde esta perspectiva, el conocimiento pedagógico
del contenido (CPC) determina, entre otras cosas, qué ideas y conceptos de
química el docente considera importante enseñar, o qué tipos de preguntas,
problemas o experiencias elige para introducir un tema, identificar las ideas
previas de sus estudiantes, o ayudarlos a construir nuevos conceptos. El conocimiento didáctico del contenido (CDC) del cual
forma parte el CPC, nos debe permitir comprender el porqué de la enseñanza de
los contenidos. En este sentido, como refieren Lozano y Penagos (2017), “el CDC
en química debe asumir una enseñanza transdisciplinar en el que se vincule el
conocimiento de ciencias sociales y humanísticas”(p.98-99).
- la Formación de profesores. Varios autores (Gil, 1991; Hewson & Hewson, 2003; Pope
& Scott, 1983) conciben la formación del profesorado como un cambio pedagógico
y particular didáctico; es decir, como un cambio en las concepciones sobre el
conocimiento y la manera en que este se construye en el medio escolar.
Es a partir de estos factores y
determinantes que el objetivo
del estudio se enfocó a diseñar un modelo para una
Unidad didáctica que promueva la formación
profesional de los estudiantes de la carrera de Pedagogía de la Química, de
la facultad de Ciencias de la Educación de la Universidad Técnica “Luis Vargas
Torres”, de Esmeraldas (UTELVT), Ecuador.
Método
El diseño de este modelo de Programación
didáctica se realizó siguiendo una vía mixta, con pautas de la Investigación
Cuantitativa Descriptiva; es decir, aquella que tiene por objetivo registrar,
analizar y describir las características observables y generales de los
fenómenos que son objetos de investigación(Behar, 2008, tomado de Abreu, 2014). Sin embargo, también se orienta transversalmente con
los enfoques exploratorio o explicativo, por cuanto tiene que ver con la
profundidad de este, cuando se investigó el nivel de conocimientos que se desea
alcanzar respecto a los conceptos básicos de la Química, circunscritos a los
lineamientos de la malla curricular de la carrera de Pedagogía de la Química de
la Facultad de Ciencias de la Educación de la Universidad Técnica “Luis Vargas
Torres” de Esmeraldas.
Los pasos del
diseño metodológico incluyeron:
· La determinación de la justificación teórica de
los elementos a introducir.
· Su contextualización.
· La definición de los objetivos.
· La definición de los contenidos.
· La precisión de la metodología, recursos y actividades a desarrollar en el aula dando atención a las necesidades educativas
específicas de los estudiantes.
· El establecimiento de los criterios e
instrumentos de evaluación.
Para llevar adelante el proceso creativo de este proyecto, se consideró
necesario definir el tipo de programación atendiendo al tiempo, de carácter
general, por unidades y semestral, de conformidad con el currículo de la
carrera de Pedagogía de la Química, por lo que para este objeto se determinó la
estructura de la programación didáctica de la Unidad I del currículo de química
del Primer año de la carrera.
Un amplio estudio documental permitió cumplir con la parte cualitativa
de la investigación. Se revisaron las obras de clásicos e investigadores más
actuales, como Antúnez (1997), Ausubel et al. (1983), Cáceres et al. (2016), Chivatá y
Cifuentes (2017), Fuentes y González (2019), Martínez et al. (2013), y Morrison,
citado por Zilberstein (1999). De sus definiciones y conceptos sobre modelos y
unidades didácticas se concreta la idea del presente estudio, donde se ve a
toda unidad didáctica como una unidad de trabajo de duración variable, que
organiza un conjunto de actividades de enseñanza-aprendizaje y que responde, en
su máximo nivel de concreción, a todos los elementos del currículo: qué, cómo,
cuándo enseñar y evaluar.
Resultados
y Discusión
Las actividades organizativas de la programación para este trabajo se
orientan al diseño didáctico y pedagógico fundamentado en los contenidos que
parten desde la Naturaleza de la ciencia y la historia de la Química para la
enseñanza de los fundamentos básicos de la Química, en particular los
contenidos referidos a los cambios químicos reversibles e irreversibles, a fin
de permitir una construcción del conocimiento científico por parte de los
estudiantes.
Se describen algunas actividades en relación con la promoción de
competencias cognitivo lingüísticas adicionales, en particular la explicación y
argumentación de los nuevos conocimientos como actividades pedagógicas.
Se consideran también las recomendaciones y la bibliografía sugerida
para el profesorado a más de algunas reflexiones sobre la aplicación de cada
una de las Unidades Didácticas de la programación didáctica planteada.
El estudio documental permitió conformar un modelo
conceptual-metodológico con fundamentos didácticos que pueden resumirse en
cuatro ideas básicas:
1)
El modelo reconoce que el aprendizaje es un proceso activo, considerando al
alumno como su propio agente.
2)
Todas las actividades dentro del modelo están interrelacionadas, guardando la
requerida coherencia y dirigidas al logro de experiencias como producto de un
enfoque global o unitaria del aprendizaje.
3)
La unidad del modelo está concebida para alcanzar metas que entrañen un
significado para el alumno porque el principal protagonista es éste.
4)
El modelo atribuye el peso de la experiencia como el foco de la idea de unidad.
Los elementos que se consideraron en el modelo
para la estructuración de la unidad didáctica se especifican a continuación:
· Selección del objetivo.
· Análisis del contenido (selección y
estructuración de conocimientos, habilidades y actitudes).
· Diagnóstico inicial (conocimientos previos,
nivel de desarrollo de las habilidades intelectuales).
· Selección de estrategias didácticas (planteamientos metodológicos,
secuencia de enseñanza, actividades de enseñanza, medios de aprendizaje).
· Selección de estrategias de evaluación
(cumplimiento del objetivo y desarrollo de la unidad).
El análisis del contenido fue doble: la estructuración de los contenidos de
enseñanza y la formación y actualización científica del profesor. La selección
y estructuración del contenido tiene que ser coherente con las actuales
concepciones sobre la naturaleza de las ciencias el contenido de enseñanza que
debe comprender la educación científica, según los elementos que constituyen la
estrategia didáctica, abordados por Luiele et al. (2017), y los aspectos a tener
en cuenta para el desarrollo de la docencia de la química abordados por Pacheco (2017).
La estructuración de los contenidos, siguiendo los presupuestos teóricos tomados
como referencia, se hizo teniendo en cuenta un conjunto de principios básicos:
· Principio del carácter científico: fomenta una
visión correcta de la realidad que presenta la ciencia contemporánea.
· Principio de sistematización: va de lo simple a
lo complejo, de lo conocido a lo desconocido.
· Principio del carácter único: articulación de
los contenidos para seguir una línea única.
· Principio de las relaciones intermaterias.
Los objetivos de aprendizaje que se proponen en esta programación son
los siguientes:
1- Ejecuta
ejercicios de conversión de unidades de medidas a los que se enfrentan en la
vida diaria aplicando factores de conversión.
2-
Distingue y asocia los conceptos fundamentales de la química que se relacionan
con la estructura atómica.
3- Ejecuta
cálculos de masa atómica, protones, electrones, neutrones, iones e isótopos.
4-
Relaciona las propiedades físicas y químicas de los elementos y sus compuestos
químicos con su estructura atómica y/o composición, con énfasis en las
implicaciones de los mismos en la vida cotidiana.
A través de los cuales se aspira, desde una visión general de la
química como ciencia natural, lograr que los estudiantes:
- Comprendan que toda la materia
del Universo está compuesta de partículas muy pequeñas que no se alcanzan a ver
a simple vista; que estas partículas interactúan de acuerdo a sus
características, formando nuevas sustancias; y que en estas transformaciones físico-químicas,
las partículas están en constante movimiento y se producen cambios que dan
origen a productos que tienen propiedades diferentes a las sustancias
iníciales.
- Reconozcan cómo se ha
desarrollado el conocimiento químico y los modelos que facilitan la comprensión
del mundo microscópico y sus interacciones en la materia inerte, los seres
vivos y el entorno.
- Analicen el comportamiento de
la materia disponible en forma de gases (como la atmósfera), sólido (como las
rocas) y líquido (como las soluciones), y que de esos análisis surge una gran
cantidad de conocimientos.
- Expliquen los aspectos
químicos que influyen en las condiciones que permiten el desarrollo de la vida
en la Tierra, y relacionen los elementos abióticos y bióticos de acuerdo a su
composición atómica y molecular. A su vez, mediante el estudio y análisis de
los materiales del entorno obtendrán explicaciones sobre las transformaciones
de la materia y su influencia en la vida cotidiana. Estudiarán las partículas
desde la Biología, la Física y la Química; por ejemplo: la conservación de la
materia y la energía, los ciclos naturales, los mecanismos de intercambio de
partículas en los seres vivos, y los modelos corpuscular y ondulatorio de la
luz. Finalmente, al observar cómo estos conocimientos se aplican en diversas
tecnologías cotidianas, comprenderán cómo contribuye la química a mejorar la
calidad de vida de las personas y cómo puede contribuir al cuidado responsable
del medio.
- Mostrar curiosidad,
creatividad e interés por conocer y comprender los fenómenos del entorno
natural y tecnológico, disfrutando del crecimiento intelectual que general el
conocimiento científico y valorando su importancia para el desarrollo de la
sociedad.
Las competencias básicas, como innovación creativa, constituyen un elemento que habrá
de trabajarse con los estudiantes para conseguir las capacidades expresadas en
los objetivos; será de importancia tipificar los contenidos en: conceptuales
(hechos, datos de realidad, nombres, características, definiciones);
procedimentales (habilidades, técnicas, destrezas) y actitudinales (valores,
normas y actitudes).
Una vez definidos los criterios necesarios, se
plantea la secuencia de enseñanza para saber cómo se van a llevar al aula los
planteamientos metodológicos. En la secuencia se resaltan las fases o etapas
incluidas en su desarrollo. Independientemente del número de fases, fue
necesario distribuir el contenido en la siguiente secuencia didáctica:
Descripción de la secuencia didáctica
para cada contenido
Contenido:
1.1- El Sistema Internacional
de Unidades
-Sistema
Internacional de Unidades.
-Análisis
dimensional: unidades de volumen, masa, temperatura, densidad y energía.
1.1.2- Factores de Conversión
- Escala centígrada.
- Escala Fahrenheit.
- Escala Kevin.
Secuencia
didáctica:
Este tema
lo comenzaremos intercambiando con los estudiantes sobre las unidades de
medidas con las que ellos se relacionan en la vida cotidiana y explicándole la
importancia que tiene el dominar las diferentes unidades de medidas, así como
la conversión de unas en otras y le proponemos las siguientes tareas:
Tarea 1:
- En qué
medidas te pesan los productos en el mercado popular y en el Supermaxi? ¿Se han
preguntado donde resulta más barato en realidad?
- En qué
unidad de medida viene la factura del consumo de agua en la casa? ¿cuántos
litros estarían consumiendo por persona?
- Hay
calor o frío cuando leemos en la prensa que la temperatura en New York es de 50
o F?
- Realmente
qué precio tiene el litro de gasolina?
Tarea 2 -
Una vez concluido este intercambio de experiencias se orientará un trabajo por
equipos cuya tarea es elaborar una tabla de conversiones con las siguientes
magnitudes:
- Masa:
Toneladas, kilogramos, gramos, libras y onzas.
-
Longitud: kilómetros, milla, metros, centímetros, pie y pulgadas.
- Volumen:
Litro, metro cúbico, ml, hl y galón.
- Densidad:
g/ cm3 y kg/m3
Temperatura:
grados Celsius, Fahrenheit y Kevin.
Se les
orientará cómo organizar el trabajo colaborativo y la importancia del mismo,
donde cada miembro del equipo se responsabiliza con una magnitud, que se
enriquece con la opinión de todos y entre todos construye la tabla de
conversiones.
Una vez
que los estudiantes han elaborado por la tabla de conversiones están en
condiciones de aplicar estos conocimientos a situaciones de la vida diaria. Se
plantearán situaciones problémicas cotidianas (consumo de agua, gasto de
combustible, emisión de CO2, etc.) en las cuales el estudiante tiene que buscar
información, organizarla y después realizar los cálculos para justificar su
respuesta.
Por lo que
le proponemos los siguientes problemas:
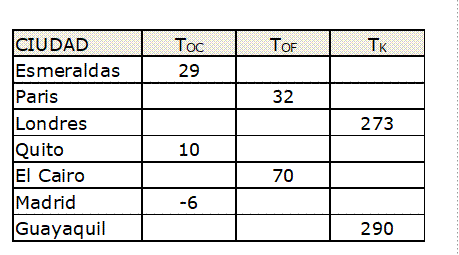 Tarea 1: Completa la siguiente tabla, que indica las
temperaturas registradas en un día para diferentes ciudades del mundo:
Tarea 1: Completa la siguiente tabla, que indica las
temperaturas registradas en un día para diferentes ciudades del mundo:
Tarea 2:
Resolver los siguientes ejercicios, aplicando las conversiones de unidades de
medidas estudiadas:
1-En
Parque Central “20 de marzo “se levanta la estatua al Prócer de Esmeraldas
“Luis Vargas Torres “. Consulte la historia de dicha estatua de bronce y su
peso y expresándolo en Toneladas, Kilogramos, libras y gramos.
2- La
distancia del Parque central a la UTELVT es de 9 ,84 km. Exprese dicha longitud
en:
a.- millas
terrestres. b.- metros. C.- pie.
2.1.-Cuántos
litros de gasolina consumirán un auto en este recorrido si su eficiencia es de
1 galón por cada 20 km.
3- Según
los estudios realizados, una persona consume al día la siguiente cantidad de
agua:
- 60 l
en la ducha.
- 3,5 l
en el lavado de manos.
- 100 l
en el uso de la lavadora.
- 20 l
en el fregado de platos.
- 10 l
en la limpieza de la casa.
3.1-
Determine cuantos galones (us) de agua consume una familia esmeraldeña de 4
personas a la semana.
3.2-Cuánto
pagaría esta familia mensualmente a la Empresa del Agua municipal por el
consumo de agua sí el precio del metro cúbico es de 0.90 USD.
3.3-
Proponga alternativas que le permita reducir el consumo de agua en un 20 %.
4- La
densidad de los huesos humanos es de aproximadamente 1,8 g/ml. Calcule el
volumen en litros (l) del esqueleto humano si su peso es de 2,7 kg.
5-
Calcular el volumen en litros de una muestra de sangre, la cual pesa 8,02 g si
se sabe que la densidad normal de la sangre es 1,06 g/ml. Si la densidad de la
sangre disminuye un 20 % en una persona con una enfermedad hepática. Cuál será
su masa para el mismo volumen.
6- La
Refinería de Esmeraldas emite diariamente a la atmósfera 0,75 ton de CO2.
Exprese esta cantidad de contaminación en kg de y libras de CO2 y explique
los efectos del CO2 en el cambio climático.
Tarea 3:
Trabajo experimental: Determinación de valores experimentales de densidad,
puntos de fusión y ebullición.
1.2.- La materia: clasificación,
propiedades y cambios de estado de la materia.
Para el desarrollo de
este tema se orientará previamente a los estudiantes la visión de estos videos
sobre la materia, sus propiedades y los cambios de estado que esta sufre,
precisándoles que el objetivo de la actividad es que ellos reconozcan las diferentes
formas en que se presenta la materia, los cambios de estado que se producen en
la naturaleza y cómo estos benefician o perjudican al ser humano, las plantas y
los animales.
https://www.youtube.com/watch?v=WyyD9tjOGs8
https://www.youtube.com/watch?v=-zB5mPADaFY
https://www.youtube.com/watch?v=SrWJtX976Es.
Tarea 1: Una vez
visualizado los materiales anteriores elaborar un resumen sobre sobre los
siguientes aspectos:
1- Las propiedades
intensivas y extensivas de la materia agregándole imágenes que ejemplifiquen
las mismas.
2- Poner ejemplos de
cambios de estado en la vida diaria y explicar cómo es el cambio de temperatura
en cada uno.
3-Señale algunos
ejemplos de beneficios y perjuicios que provocan los cambios de estado en la
naturaleza.
1.2.1-Mezclas homogéneas y heterogéneas.
Métodos de separación de mezclas.
Este tema lo
abordaremos presentándoles algunas muestras de mezclas (aceite y vinagre, café
con leche, aserrín y virutas de hierro), haciendo notar las diferencias que se
aprecian entre ellas y proponiendo la siguiente pregunta: ¿cómo pudiéramos
separa esas mezclas?
El objetivo que nos
proponemos es que los estudiantes sean capaces de clasificar las mezclas y
desarrollar la separación de las mismas basado en sus propiedades y utilizando
los instrumentos de laboratorio adecuados.
Tarea 1: Una vez que
los estudiantes han visualizados los videos que aparecen en :
https://www.youtube.com/watch?v=QiH3MelnWLk
https://www.youtube.com/watch?v=aknBwDJwG_4.
Presentarán un trabajo
por equipo basado en el siguiente enunciado:
“La refinación del
petróleo, la producción de sal y la extracción de aceite de palma algunos de
los principales renglones económicos de nuestra provincia”.
1–Investigue sobre
estos procesos industriales e identifique que mezclas se utilizan en los mismos
y qué métodos se utilizan para su separación y obtención de los productos
finales.
2- ¿En estos procesos
se producen desechos qué contaminan el medio ambiente? ¿De qué manera?
3- Grafique las
respuestas
Tarea 2 – Práctica de
laboratorio 1- Métodos de Separación de Mezclas: Evaporación, Filtración,
Destilación. Decantación.
Tarea 3- Visita a la
Refinería de Esmeraldas.
Elaboración y
presentación de un informe resumen sobre los métodos de separación de mezclas
aplicados en la refinación del petróleo.
1.3.- Estructura Atómica: El Átomo.
- Definición.
Modelos Atómicos.
- Constitución:
Protones, Neutrones y Electrones.
- Átomos neutros e
iones.
En el aprendizaje de
la química los estudiantes las falencias conceptuales de los estudiantes está
motivada por una insuficiente comprensión de los tres niveles de descripción de
la materia: macroscópico, microscópico y representacional que se vale de símbolos,
formulas y ecuaciones, por lo que en el desarrollo de este tema la estrategia
didáctica está encaminada a que el estudiante construya sus modelos sobre el
átomo a partir del estudio de los diferentes modelos establecidos.
Una vez explicados los
objetivos de aprendizaje de la clase le solicitamos:
1. Cuáles son las
partículas que constituyen un átomo?
2. Realice un esquema
sobre el átomo.
A continuación,
proyectamos los siguientes materiales
1- Estructura atómica:
protones, neutrones y electrones.
https://www.youtube.com/watch?v=8uvluIhFX9I.
2- Modelo atómico de
Thompson
https://www.youtube.com/watch?v=qzXvNh-mwys.
3- Modelo atómico de
Bohr.
https://www.youtube.com/watch?v=_RUAuoj8Ha4
4- Modelo atómico de
Rutherford.
https://www.youtube.com/watch?v=Q-SkO1coeRA.
Tarea 1: Al concluir
la visualización de los videos cada equipo elaborará y expondrá su propuesta
sobre la estructura del átomo y presentará su modelo sobre el átomo para lo
cual deben consultar en la web sobre Modelos atómicos y estructura del átomo.
Tarea 2: Consulte en
la web la definición de Isótopos, Isobaros e Isótonos. Ponga ejemplos de cada
uno y mencione 5 aplicaciones de los Isótopos.
1.4- Conceptos Básicos:
- Elemento químico,
sustancia simple y compuesto químico.
- Moléculas
homonucleares y heteronucleares.
- Número atómico
(Z).
- Masa atómica (A).
- Isótopos. Isobaros
e Isótonos.
Una vez estudiado la
estructura del átomo les planteamos a los estudiantes la posibilidad de
relacionar los conocimientos previos sobre la composición del átomo con los
conceptos de Número atómico (Z) y Masa atómica (A). Isótopos. Isobaros e
Isótonos.
Para guiar a los
estudiantes planteamos las siguientes preguntas:
- Qué partículas
constituyen el átomo?
- Cuáles de las
partículas del átomo tienen una masa apreciable? ¿Dónde se encuentran?
- Qué carga
presentan las diferentes partículas del átomo?
Una vez debatidas las
respuestas le planteamos a los alumnos que :
- Si definimos la
masa atómica como (A) propongan una fórmula que nos permita calcular dicha
masa.
- A qué se deberá
que el átomo sea neutro.
Una vez analizadas las
respuestas concluimos que:
1- A = Z+n0, donde (Z)
es la cantidad de protones y se define como Número atómico.
2- El átomo es neutro
porque la cantidad de protones en el núcleo es igual que la cantidad de
electrones en la corteza.
Al concluir retomamos
la tarea 2 de la clase anterior y reforzamos el concepto de Isótopos, Isobaros
e Isótonos.
Tarea 1: Resumir los
conceptos fundamentales que se han estudiado en esta unidad
1. Materia: Es todo
aquello que tiene masa y ocupa un lugar en el espacio. Este término engloba
todos los cuerpos, objetos y seres que existen en la naturaleza. En una primera
instancia se pueden distinguir tres grandes sistemas de materia:
Mezclas heterogéneas,
mezclas homogéneas y sustancias puras.
2. Materiales: son en
general las distintas formas en que la materia se presenta, sea cual sea su
estado físico, sólido, líquido o gaseoso.
3. Masa: es la
cantidad de materia que tiene un cuerpo, y se mide con un instrumento que se
llama balanza; es independiente de la fuerza de gravedad y permanece constante
en cualquier punto de la Tierra o del Universo donde se determine.
4. Peso: es la fuerza
con que la Tierra atrae un cuerpo, y se mide con un instrumento llamado
dinamómetro; depende de la fuerza de gravedad y varía según la posición del
cuerpo sobre la Tierra o en el Universo.
5- Densidad: es la
masa de un material contenida en una unidad de volumen.
6. Volumen: se refiere
al espacio ocupado por un material en cualquier estado físico.
7-Temperatura: es la
medida del grado de calor de un cuerpo; no mide el calor en sí, sino el grado
de calor. Por lo tanto, su medición implica unidades de grados (°C, °K o °F).
8- Calor: es una forma
de energía y como tal se mide en calorías.
9. Punto de
ebullición: es la temperatura constante de una sustancia en estado líquido
cambia al estado físico gaseoso, a la presión de 1 atm.
10. Punto de fusión:
es la temperatura constante a la que una sustancia cambia su estado físico
sólido al líquido, a la presión de 1 atm.
11. Solubilidad: es la
máxima cantidad de sustancia o soluto que puede disolverse en una cantidad
determinada de solvente a una temperatura fija. Se expresa gramos de soluto
disuelto por 100 cm3 de solvente.
12. Mezclas
heterogéneas. Son sistemas de materia en los que se distinguen a simple vista
dos o más materiales (de ahí su aspecto heterogéneo). Por ejemplo: madera y
petróleo, agua y aceite, arena y agua, granito, mármol, agua y petróleo, etc.
13. Mezclas
homogéneas. Son sistemas de materia en los que no se distingue a simple vista
que esté formado por dos o más constituyentes. Hay dos grandes tipos de mezclas
homogéneas: las disoluciones y los coloides.
14. Los elementos
también llamados sustancias simples, son las sustancias elementales que
constituyen la materia. Se combinan en proporciones fijas de masa para formar
los compuestos. Los elementos no se descomponen en sustancias más sencillas. Se
clasifican en metales, no metales y metaloides
15. Los compuestos,
llamados también sustancias compuestas, están formados por dos o más elementos
unidos químicamente en proporciones fijas de masa. Se descomponen en sustancias
más simples o elementos constituyentes.
16. Las propiedades de
los metales son entre ellas, buenos conductores de la electricidad y del calor.
Suelen ser opacos o de brillo metálico, tienen alta densidad, pueden ser
estirados en hilos ni aplanados en láminas, tienen un punto de fusión alto, son
duros, y son buenos conductores (calor y electricidad). Poseen alta densidad y
son sólidos en temperatura ambiente, excepto el mercurio.
17-Las propiedades de
los no metales son entre otras, malos conductores de electricidad y de calor.
No tienen brillo metálico y no reflejan la luz. Por su fragilidad no pueden ser
estirados en hilos ni aplanados en láminas. Se encuentran en los tres estados
de la materia a temperatura ambiente. Sus puntos de fusión son más bajos que
los de los metales.
18-Partículas
químicas: Son las pequeñas unidades que integran a una sustancia. Son muy
pequeñas y muy ligeras. Tanto que en unos cuantos gramos de cualquier sustancia
hay del orden de un cuatrillón de partículas. Están constituidas por un cierto
número de núcleos (con carga eléctrica positiva) interactuando con un cierto
número de electrones (con carga eléctrica negativa). Pueden ser iones
(partículas cargadas mono o polinucleares),Moléculas (Partículas polinucleares
neutras, formada por dos o más átomos unidos entre sí por enlaces químicos) o
átomos (partículas mononucleares neutras, y que son la unidad básica de la
materia).
Conceptos
fundamentales:
Tarea 2:
Se orientará elaborar un Mapa conceptual por equipos, aplicando el programa
CmaapTools, el cual expondrán en la próxima clase, y que al final debe recoger
los siguientes conceptos.
1.5- Tabla Periódica.
- Grupos o
Familias y Períodos.
- Distribución
y configuración electrónica del Átomo.
- Números
cuánticos.
- Propiedades
atómicas y su variación Periódica.
Tarea de
aprendizaje cooperativo:
Para el
desarrollo de este tema se orientará la elaboración de un portafolio para lo
cual el profesor tiene que explicarle a los estudiantes los objetivos que se
persigue con este trabajo y cómo elaborar el portafolio:
-CONTENIDOS
A DESARROLLAR EN EL PORTAFOLIO.
1. Concepto
y cantidad de grupos. Cómo se nombra cada grupo.
2. Concepto
y cantidad de Períodos.
3. Configuración
electrónica más externa de los elementos de cada grupo.
4. Metales
y no metales.
5. Ejemplos
de aplicaciones de algunos metales y no metales.
6. Propiedades
atómicas.
7. Tipos
de enlaces químicos. Ejemplos.
8. Propiedades
de las sustancias según el tipo de enlace.
ESTRUCTURA DEL PORTAFOLIO.
1- Una
guía o índice de contenidos y el tipo de trabajo y estrategia didáctica que se
seguirá (el profesor da una orientación inicial y se estimula la creatividad
por parte del alumno).
2- Una
introducción que detalle los objetivos, conocimientos y punto de partida
inicial para el estudio y aprendizaje de la tabla periódica.
3- Un
capítulo con los temas centrales que conforman el cuerpo del portafolio y que
contienen la documentación seleccionada por el alumno que muestra el
aprendizaje conseguido en los temas orientados.).
4- Un
capítulo de conclusiones como síntesis del aprendizaje adquirido sobre los
contenidos impartidos.
- En la
elección del portafolio hay que concretar los siguientes aspectos:
1-Autoría
y audiencia del portafolio.
2-Contenidos
a desarrollar.
3-Objetivos
y competencias.
4-Estructura
y organización.
5-Criterios
de evaluación.
- Fases
para el desarrollo del portafolio.
1-Recogida
de evidencias
-Informaciones
de diferentes tipos de contenidos (conceptual, procedimental y actitudinal).
-Tareas
realizadas en clases o fuera de ellas (mapas conceptuales, recortes, etc.).
-Documentos
en diferentes soportes (digital, papel, etc.).
2-Selección
de evidencias.
En esta
fase los alumnos eligen los mejores trabajos para ser presentados al profesor y
al resto de sus compañeros.
3-Reflexión
sobre las evidencias.
Se
planifican sesiones para reflexionar sobre los aprendizajes adquiridos.
4-Presentación
del portafolio.
Características principales
de los enlaces químicos.
Características
principales de los enlaces químicos. Este tema comenzará con una tarea previa
donde los estudiantes deben consultar en la web :
Tarea 1:
Consulte sobre las propiedades que presentan las siguientes sustancias
químicas: Cl2, NaCl, Fe, H2O, Cu-Sn, Fr2 O, N2 y HF, agrúpelos según la
similitud en sus propiedades e intente relacionar sus propiedades con la
composición de los mismos. Mencione algunas aplicaciones de estos compuestos en
la vida diaria.
Al
comenzar la clase se les pedirá a los estudiantes exponer sus investigaciones y
estimular las opiniones de los otros compañeros. Al finalizar las exposiciones
el profesor resumirá los aspectos estudiados:
- El Cl2 y
el N2 presentan enlace covalente apolar pues existe un compartimiento de
electrones entre átomos de igual electronegatividad.
- El H2O y
el HF presentan enlace covalente polar pues existe un compartimiento de
electrones entre átomos no metálicos de diferentes electronegatividades.
- El NaCl
y el Fr2O presentan enlace iónico al producirse una transferencia de electrones
desde el metal hacia el no metal, formándose un ion positivo (metal) y uno
negativo (no metal).
- El Fe y
la aleación de Cu y Sn presentan enlace metálico ya que se produce una
atracción entre los iones positivos del metal y los electrones deslocalizados.
Tarea 2 :
Elabore una tabla donde se resuma los siguientes aspectos :
- Tipo de
enlace.
- Cómo se
forma el enlace.
- Qué tipo
de elementos lo forman.
- Qué
propiedades presentan las sustancias que poseen este enlace.
Tarea 3 :
Dadas las siguientes sustancias:
a) CF4
b) Br: Br c) MgF2 d) Fe-Al. e): Ö : Ö
3.1- Qué
tipo de enlace (Covalente Polar, Covalente Apolar, Iónico y Metálico) presenta
cada uno.
3.2- A qué
sustancias pertenecen las siguientes características y propiedades?
- Presenta
un enlace doble: ____________.
- Buenos
conductores de la electricidad: ___________.
- Cada
átomo tiene un par de electrones pareados y 3 electrones libres: ____________.
- Son
gases, sólidos y líquidos malos conductores de la electricidad: _______________.
- Se
produce entre átomos no metálicos de diferentes electronegatividades: __________.
- Son
maleables y dúctiles: _____________________.
-
Presentan bajos puntos de fusión y ebullición: _______________________.
- Presenta
mejores propiedades que los metales por separado: ______________.
- Los
metales transfieren electrones a los no metales: ______________.
-Cada
átomo comparte electrones para completar su última capa: __________________.
Los
aprendizajes adquiridos en esta unidad brindarán a los estudiantes los
conocimientos teóricos y las herramientas necesarias para comprender las
reacciones químicas como parte de la naturaleza, la aplicación en la industria,
la agricultura, la alimentación y el bienestar de los seres vivos. Además, le
servirá para comprender los procesos de transformación materia – energía en la
interrelación con otras materias en el trascurso de la carrera y su vida
profesional.
En cuanto a los principios metodológicos,
la idea fundamental se sustenta en que los estudiantes son
los principales partícipes de su propio aprendizaje, convirtiéndose el profesor
en un mediador o guía de este proceso de enseñanza, lo que facilita el
establecimiento de relaciones entre los conocimientos y experiencias previas y
los nuevos contenidos.
El enfoque pedagógico para el desarrollo del proceso de enseñanza
aprendizaje se estructuró bajo el enfoque del aprendizaje
cooperativo–colaborativo, el cual permite organizar las actividades en equipos
de trabajo; además, se fundamenta en la corriente epistemológica
constructivista que permite un aprendizaje significativo en los estudiantes, un
enfrentamiento entre los conocimientos previos y los nuevos conocimientos, así
como la preparación del estudiante para aplicar estos conocimientos en
cualquier entorno, a partir de presentar al estudiantes diferentes situaciones
problémicas, las cuales no solo están enfocadas a hacer uso de las concepciones
alternativas de los estudiantes sino también a la didáctica multisensorial, el
trabajo cooperativo, el uso de las TIC y la atención a las necesidades
educativas especiales.
El conjunto de estudiantes de primer año de la carrera de Pedagogía de
la Química constituye un mosaico diverso en cuanto a preparación académica,
motivación hacia la profesión y procedencia socio económica, lo cual precisa
que nuestro proyecto tenga un carácter inclusivo, diverso y diferenciador para
lograr una formación adecuada tanto desde el punto de vista académico como
profesional.
Este proceso creativo tendrá los elementos metodológicos diseñados,
tanto en función de los principios psicopedagógicos como de las referencias
recogidas en la normativa vigente en la Ley Orgánica de la Educación Superior
(2010).
El sistema de evaluación del aprendizaje parte de la definición de los
criterios de evaluación siguientes:
1-Identifica y utiliza
los principios y procedimientos pertinentes.
2-Realiza los cálculos
con precisión y exactitud adecuada.
3-Plantea las
respuestas con sus respectivas unidades de medidas correctamente.
4-Describe las
principales partículas fundamentales y conoce el significado de términos
relacionados, tales como: Número atómico, Masa atómica, Isótopos e Iones.
5-Interpreta la
variación periódica de algunas propiedades de los elementos de la Tabla
Periódica (Potencial de ionización, afinidad electrónica, electronegatividad y
radio atómico).
6-Comprende las
propiedades generales de los diferentes compuestos químicos relacionándolas con
el tipo de enlace.
Igualmente
se diseñan las tareas y actividades (individuales y cooperativas) que forman
parte de los diferentes tipos y momentos de evaluación (diagnóstica, formativa
y sumativa), así como los instrumentos que se utilizarán.
Conclusiones
La propuesta de diseño de una Unidad Didáctica para el
primer año de la carrera de formación de profesores de química sugiere un grupo
de estrategias para enseñar los conceptos fundamentales de la química relacionados
con la materia y la estructura atómica. Pretendemos, de manera dinámica y
activa, ir transmitiendo a los futuros docentes las experiencias adquiridas en
el proceso de enseñanza aprendizaje e identificando los objetivos de esta
propuesta.
La propuesta de esta unidad didáctica responde
a la necesidad de actualizar las estrategias de enseñanza de la química a las
exigencias del mundo actual, donde el desarrollo de las nuevas tecnologías (TIC)
impone un reto importante a los docentes en la conducción del proceso de
enseñanza aprendizaje. La integración de nuevos contenidos y la pretensión de
que los mismos se acerquen cada vez más a la vida cotidiana del estudiante,
exige que la apropiación de los conocimientos tenga un carácter significativo, es
decir que el estudiante esté capacitado para aplicar los conocimientos
adquiridos en cualquier entorno de su realidad.
La enseñanza de la Química no puede reducirse a
dictar conceptos y teorías, a un proceso de memorización en abstracto. Se
requiere de una mayor dinamización de las clases, que los estudiantes vean la
aplicación práctica de todos esos conceptos y teorías estudiadas en clases en
su vida diaria,
en la agricultura, en la industria, en la medicina, etc. El objetivo es formar
profesionales que observen el aprendizaje como una construcción del
conocimiento y no como una transmisión de información.
y Carmen D. Gracia García